Задачи практикума
Разделение смесей и очистка
веществ
Факторы, влияющие на
качество перегонки (2)
Работа выполняется на РМС «Перегонка»
Задача.Установить, как наличие дефлегматора влияет на
качество перегонки.
Теория. Перегонка - способ разделения смесей, основанный
на разнице в температурах кипения их компонентов. При перегонке
жидкость нагревают, а ее пары конденсируют. При этом компоненты смеси
выкипают в порядке повышения их температур кипения. В идеале, пока
выкипает данная жидкость, ее температура, а также температура паров над
ней остается постоянной и равной ее температуре кипения. Реально, из-за
неравномерности нагрева, жидкость частично перегревается и равновесие
между жидкостью и паром не всегда успевает установиться. В этом случае
вместе с низкокипящей жидкостью испаряется некоторое количество
высококипящей и разделение оказывается менее полным. Чтобы
способствовать установлению равновесия жидкость-пар используют
дефлегматор - специальную колонку с большой внутренней поверхностью,
на которой многократно происходит конденсация и испарение.
В
данном опыте мы будем перегонять смесь воды (t°кип =
100°С) и моноэтаноламина (t°кип = 175°С).
Дистиллированная вода почти не проводит электрический ток, раствор
моноэтаноламина в воде - проводит. По электропроводности отгона можно
судить о концентрации моноэтаноламина в нем, а значит, и о полноте
очистки воды.
План работы. Перегоняют смесь воды с моноэтаноламином
сначала без дефлегматора, а потом - с дефлегматором. Записывают
зависимость электропроводности отгона от температуры. Сравнивают
электропроводность отгона в двух случаях.
|
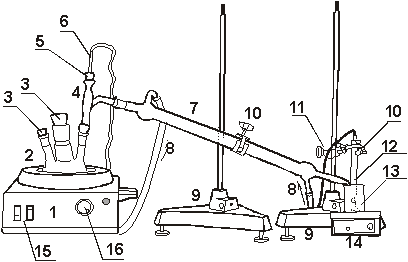 Рис. 1. Установка для перегонки без
дефлегматора . 1 - колбонагреватель, 2 - трехгорлая колба, 3 -
пробки, 5 - насадка Вюрца, 6 - резиновая пробка, 7 - датчик
температуры, 8 - холодильник, 9 - шланги резиновые (указано
направление тока воды), 10 - штативы, 11 - лапки, 12 -
муфта, 13 - датчик электропроводности, 14 - химический стакан,
15 - магнитная мешалка, 16 - кольцо, 17 - выключатели
колбонагревателя, 18 - регулятор колбонагревателя.
Рис. 1. Установка для перегонки без
дефлегматора . 1 - колбонагреватель, 2 - трехгорлая колба, 3 -
пробки, 5 - насадка Вюрца, 6 - резиновая пробка, 7 - датчик
температуры, 8 - холодильник, 9 - шланги резиновые (указано
направление тока воды), 10 - штативы, 11 - лапки, 12 -
муфта, 13 - датчик электропроводности, 14 - химический стакан,
15 - магнитная мешалка, 16 - кольцо, 17 - выключатели
колбонагревателя, 18 - регулятор колбонагревателя.
|
Оборудование. Датчик температуры в пробке под насадку
Вюрца; датчик электропроводности; компьютер с измерительным блоком;
прибор для перегонки: колба трехгорлая на 500 мл, дефлегматор, насадка
Вюрца, холодильник, штатив с лапками и муфтами; колбонагреватель;
подъемный столик или штатив с кольцом; цилиндр мерный на 100 мл;
химический стакан на 100 мл; кипелки (длинные капилляры, запаянные с
одного конца или фарфоровая крошка); 2 пробки на 14 и одна на 29.
Реактивы. Смесь воды с моноэтаноламином (80% воды по
массе) - 100 мл.
Подготовка к работе. К первому разъему измерительного
блока подключают датчик температуры, ко второму - кондуктометр. В меню
программы L-химия практикум(РМС «Перегонка») выбирают пункт
«Факторы, влияющие на качество перегонки». Переходят в окно измерений.
В сценарии реализован непрерывный режим записи.
Ход работы. Собирают прибор для перегонки без
дефлегматора (Рис. 1) (насадку Вюрца подсоединять к боковому горлу
колбы). В трехгорлую колбу через одно из боковых горл наливают
цилиндром 100 мл (ровно) смеси жидкостей и помещают кипелки., погружают
датчик электропроводности в пустой стаканчик так, чтобы между ним и
дном стакана был небольшой зазор.
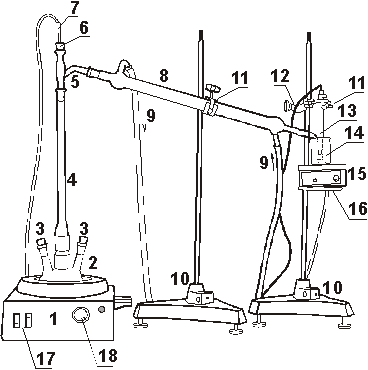 Рис. 2.
Установка для перегонки с дефлегматором. 1 - колбонагреватель,
2 - трехгорлая колба, 3 - пробки, 4 - дефлегматор, 5 - насадка
Вюрца, 6 - резиновая пробка, 7 - датчик температуры, 8 -
холодильник, 9 - шланги резиновые (указано направление тока
воды), 10 - штативы, 11 - лапки, 12 - муфта, 13 - датчик
электропроводности, 14 - химический стакан, 15 - магнитная
мешалка, 16 - кольцо, 17 - выключатели колбонагревателя, 18 -
регулятор колбонагревателя.
Рис. 2.
Установка для перегонки с дефлегматором. 1 - колбонагреватель,
2 - трехгорлая колба, 3 - пробки, 4 - дефлегматор, 5 - насадка
Вюрца, 6 - резиновая пробка, 7 - датчик температуры, 8 -
холодильник, 9 - шланги резиновые (указано направление тока
воды), 10 - штативы, 11 - лапки, 12 - муфта, 13 - датчик
электропроводности, 14 - химический стакан, 15 - магнитная
мешалка, 16 - кольцо, 17 - выключатели колбонагревателя, 18 -
регулятор колбонагревателя.
|
Включают охлаждающую воду и ставят регулятор колбонагревателя в
положение «max». Нажатием на экранную кнопку «Пуск»запускают процесс
измерения. Включают магнитную мешалку. Когда начнется кипение,
переводят нагреватель в среднее положение. В ходе перегонки положение
нагревателя поддерживают таким, чтобы одна капля отгона капала за 2-3
секунды. Пока в приемник не начал поступать отгон, датчик
электропроводности показывает нуль. Как только жидкость, поступившая в
приемник, зальет контакты кондуктометра, программа начнет показывать
электропроводность. Следует помнить, что программа изменяет значение
температуры и электропроводности достаточно редко - 1 раз в 10 секунд.
Продолжают нагревание до тех пор, пока не выкипит вода, что можно будет
увидеть по резкому подъему температуры паров или (если нагревание
недостаточно мощное) - по прекращению кипения. После этого нагревание
прекращают. Останавливают измерение нажатием экранной кнопки «Стоп» и
сохраняют результаты нажатием экранной кнопки «Архив».
Собирают прибор для перегонки с дефлегматором (Рис. 2) и процедуру
повторяют. При этом нагрев должен быть более мощным, так как большая
часть отгона конденсируется в дефлегматоре.
Обработка результатов. Полученные в работе файлы
открывают в программе Excel. В них - два столбца. Первый столбец -
температура, второй - электропроводность отгона. Сравнивают температуры
кипения и электропроводность в двух случаях и делают вывод об
эффективности перегонки.
Отчет. В отчете должны присутствовать графики зависимости
электропроводности отгона от температуры пара, вывод о том, связаны ли
эти параметры и вывод о влиянии дефлегматора на чистоту отгона.
Дополнительные исследования. В порядке дополнительных
исследований можно изучить чистоту отгона в зависимости от мощности
нагревания. Для этого повторяют опыт с дефлегматором, но
колбонагреватель включают на максимум. Также можно исследовать влияние
разницы температур кипения на качество отгонки. Для этого проводят
перегонку смеси воды и уксусной кислоты (tкип =
118°С).
Получение кривой перегонки смеси жидкостей. Определение
состава смесей жидкостей по ее кривой перегонки (1)
Работа выполняется на РМС «Перегонка».
Задача. Определить состав смеси воды с ацетоном.
Теория. Перегонка - способ разделения смесей, основанный
на разнице в температурах кипения их компонентов. При перегонке
жидкость нагревают, а ее пары конденсируют. При этом компоненты смеси
выкипают в порядке повышения их температур кипения. Пока выкипает
данная жидкость, температура паров над ней остается постоянной и равной
ее температуре кипения. Когда вся жидкость из смеси выделяется,
температура возрастает до температуры кипения следующей жидкости.
Зависимость температуры от массы отогнанной жидкости называется кривой
перегонки. По кривой перегонки можно установить состав исходной смеси
(точнее, массу каждого компонента, выкипающего при соответствующей
температуре).
План работы. Берут навеску смеси. Перегоняют ее,
записывая зависимость массы отгона от температуры (кривую перегонки).
По скачку на кривой перегонки определяют массу ацетона в пробе. Зная
массу пробы и массу ацетона в ней, рассчитывают массовую долю ацетона.
Оборудование. Весы; термодатчик в пробке под насадку
Вюрца; компьютер с измерительным блоком; прибор для перегонки: колба
круглодонная на 250 мл, дефлегматор, насадка Вюрца, холодильник, штатив
с лапками и муфтами, газовая горелка, колбонагреватель, подъемный
столик или штатив с кольцом под весы, приемный стаканчик на 100 мл или
цилиндр на 100 мл; две пробки; кипелки.
Реактивы. Смесь воды с ацетоном (состав задает
преподаватель) - 100 г.
|
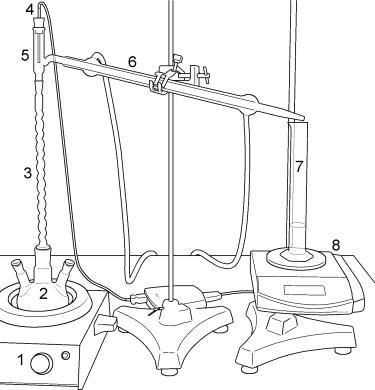 Рис. 3
Прибор для перегонки. 1 - колбонагреватель, 2 - колба, 3 -
дефлегматор, 4 - термодатчик, 5 - насадка Вюрца, 6 -
холодильник, 7 - цилиндр, 8 - весы
Рис. 3
Прибор для перегонки. 1 - колбонагреватель, 2 - колба, 3 -
дефлегматор, 4 - термодатчик, 5 - насадка Вюрца, 6 -
холодильник, 7 - цилиндр, 8 - весы
|
Подготовка к работе. Собирают прибор для перегонки (Рис.
3). На весах в мерном цилиндре отвешивают 100 г (ровно) смеси
жидкостей, переливают в трехгорлую колбу через одно из боковых горл,
помещают в колбу кипелки и затыкают горла пробками. Собирают прибор для
перегонки (Рис. 3). К первому разъему измерительного блока подключают
датчик температуры. К USB-порту подключают весы. Приемник ставят на
весы и проводят обнуление тары. В меню программы L-химия -
практикум (РМС «Перегонка») выбирают пункт «Получение кривой
перегонки смеси жидкостей». Выходят в окно измерений. Сценарий работает
в непрерывном режиме.
Ход работы. Регулятор колбонагревателя ставят в среднее
положение и включают охлаждающую воду. Нажимают экранную кнопку
«Пуск». Программа начинает записывать кривую перегонки. Положение
регулятора нагревателя поддерживают так, чтобы в минуту в приемник
попадало 1-2 г отгона. Отгон ведут до тех пор, пока в приемнике не
окажется 80-90 г отгона (нельзя упаривать содержимое исходной колбы
насухо). Выключают нагрев, останавливают измерение нажатием экранной
кнопки «Стоп» и сохраняют результаты нажатием экранной кнопки «Архив».
Обработка результатов. Полученные в работе файлы
открывают в программе Excel. В нем - два столбца. Первый столбец -
температура отгона, второй - его масса. Строят кривую перегонки
(зависимость массы от температуры). По изменению массы при
соответствующей температуре определяют массы всех компонентов, кроме
кипящего последним. Массу компонента, кипящего последним, определяют по
разности между массой исходной смеси и массой отгона до начала кипения
последнего компонента.
Отчет. В отчете должна присутствовать кривая перегонки
(зависимость массы отгона от температуры), формулы для расчета массовой
доли ацетона в смеси, обоснование подставления тех или иных значений в
формулу (откуда взяли эти значения) и, в выводе - массовая доля ацетона
в смеси.
Изучения полноты промывания
осадка и подбор оптимальных условий промывания (2)
Работа выполняется на РМС «Кондуктометрия» или УРМС. Возможно
выполнение на РМС «Перегонка».
Задача. Установить оптимальный режим промывания осадка.
Теория. При образовании нерастворимых веществ в осадок
обычно увлекается некоторое количество маточного раствора с
содержащимися в нем примесями. Чтобы удалить эти примеси, осадок
промывают дистиллированной водой. Полнота промывания зависит от объема
промывной воды в каждой порции, количества порций и длительности
промывания.
План работы. Готовят осадок и промывают его водой, каждый
раз измеряя электропроводность промывной воды. Процесс проводят с
порциями промывной воды в 40 и 100 мл.
Оборудование. Датчик электропроводности, компьютер с
измерительным блоком, магнитная мешалка, стаканчик на 100 мл, мерный
стаканчик на 50 мл, штатив химический.
Реактивы. BaCl2 0.2М и
Na2SO4 0.2М.
Подготовка измерительной системы. Закрепляют датчик
электропроводности в штативе, погружают в стаканчик и подключают его к
первому разъему измерительного блока. В меню программы L-Химия -
практикум, раздел «Датчики», выбирают пункт «Датчик
электропроводности: Два диапазона (по выбору): Ручной ввод абсциссы».
Выходят в окно измерений.
Ход работы. В стаканчик на 100 мл наливают 50 мл
BaCl2 0.2М. Стаканчик ставят на магнитную мешалку, включают
перемешивание. Из стаканчика на 50 мл добавляют 50 мл
Na2SO4 0.2М. Через несколько секунд останавливают
перемешивание и отстаивают выпавший BaSO4. Когда осадок
отстоится, аккуратно (чтобы не слить осадок) и возможно более полно
сливают с него маточный раствор. Заливают осадок 40 мл дистиллированной
воды (отмеряя ее стаканчиком на 50 мл), погружают датчик, переключенный
на диапазон 0.5-5 мСм/см. включают перемешивание, запускают измерение
нажатием на экранную кнопку «Пуск». Значение электропроводности
выводится на верхний индикатор в правом верхнем углу экрана, сверху в
центре экрана выводится время от последнего нажатия кнопки «Пуск» или
«Выбор». Когда электропроводность перестанет расти, нажимают кнопку
«Выбор». В появившемся окне вводят значение абсциссы «1» (номер
промывания). Мешалку выключают, дают осадку отстояться, сливают с него
маточный раствор. Вновь заливают осадок дистиллированной водой,
погружают датчик электропроводности, включают мешалку и, когда
электропроводность перестанет расти, нажимают экранную кнопку «Выбор».
При этом в появляющемся окне всегда вводят номер промывания. Процедуру
повторяют несколько раз. Когда значение электропроводности оказывается
меньше 1 мСм/см, переключают диапазон на датчике
электропроводности. При этом значение электропроводности выводится на
втором сверху экранном индикаторе. Промывание считают законченным,
когда электропроводность новой порции маточного раствора не станет
такой же, как электропроводность предыдущей. Останавливают измерение
нажатием экранной кнопки «Стоп» и сохраняют результаты нажатием
экранной кнопки «Архив». Отмечают, сколько порций воды потребовалось,
чтобы промыть осадок.
Полностью повторяют аналогичный опыт, но промывают осадок порциями не
по 40, а по 100 мл.
Отчет. В отчете должны быть приведены
зависимости электропроводности от номера промывания для двух серий
(промывание по 40 и 100 мл) и выводы. В выводах должно быть указано:
а) приблизительное время промывания осадка каждой порцией
б) количество порций и суммарный объем воды, ушедшей на промывание.
в) какой режим промывания оптимален с точки зрения экономии воды, а
какой - с точки зрения экономии времени.
Растворы и
кристаллогидраты
Приготовление раствора
заданной молярной концентрации (1)
Работа выполняется на РМС «Стехиометрия» или УРМС.
Задача. Приготовить раствор заданной молярной
концентраиции.
Теория. Молярная концентрация - количество вещества в 1
литре раствора. Для приготовления раствора заданной молярной
концентрации берут навеску вещества, содержащую его определенное
количество, количественно (т.е. без потерь) переносят в мерную колбу,
растворяют в воде и доводят объем раствора до метки.
Оборудование. Весы, мерная колба определенного объема,
стаканчик для взвешивания, шпатель.
Реактивы. K2CO3 или
K2Cr2O7 или
K3[Fe(CN)6] любой другой реактив, который можно
использовать в качестве первичного стандарта.
План работы. Рассчитывают навеску вещества, которая
необходима для приготовления данного объема раствора данной
концентрации. Берут эту навеску, растворяют в воде и доводят объем
раствора до заданного.
Ход работы. У преподавателя получают реактив и мерную
колбу. Преподаватель также сообщает необходимую концентрацию раствора.
Рассчитывают необходимую навеску. Стаканчик для взвешивания ставят на
весы и обнуляют тару. Шпателем насыпают реактив в стаканчик для
взвешивания до тех пор, пока масса реактива в стаканчике не превысит
расчетную. После чего из стаканчика начинают шпателем отбирать реактив.
Если масса реактива по-прежнему превышает расчетную, отобранный реактив
отбрасывают в емкость для слива, если оказывается ниже расчетной - из
шпателя потихоньку насыпают реактив в стаканчик для взвешивания до тех
пор, пока его масса не сравняется с расчетной.
Навеску реактива заливают дистиллированной водой, перемешивают в
стаканчике круговым движением и переносят в мерную колбу. Так до тех
пор, пока весь реактив не окажется в мерной колбе. После чего
перемешивают круговыми движениями реактив в мерной колбе и, когда он
полностью растворится, объем раствора доводят водой до метки. Затыкают
мерную колбу и перемешивают ее содержимое, опрокидывая колбу не менее
15 раз.
Отчет. В отчете должна быть формулировка задачи с
указанием конкретного вещества, объема и концентрации раствора, который
предполагается приготовить. Также должны быть приведены формулы для
расчета навески и указана навеска вещества.
Определение содержания воды
в кристаллогидрате (1)
Работа выполняется на РМС «Стехиометрия» или УРМС.
|
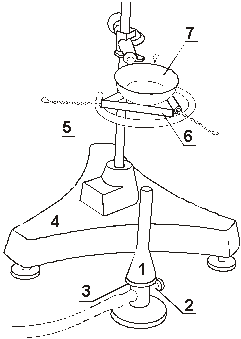 Рис. 4. Разложение
кристаллогидрата. 1 - газовая горелка, 2 - регулятор
расхода газа в горелке, 3 - кольцо, регулирующее приток
воздуха в горелку, 4 - штатив, 5 - кольцо, 6 -
фарфоровый треугольник, 7 - чашка для выпаривания.
Рис. 4. Разложение
кристаллогидрата. 1 - газовая горелка, 2 - регулятор
расхода газа в горелке, 3 - кольцо, регулирующее приток
воздуха в горелку, 4 - штатив, 5 - кольцо, 6 -
фарфоровый треугольник, 7 - чашка для выпаривания.
|
Задача. Определить состав кристаллогидрата, то есть
количество молекул воды, приходящееся на одну формульную единицу.
План работы. Берут навеску кристаллогидрата, нагревают
ее до удаления воды и взвешивают. По разности рассчитывают массу
потерянной воды, а из нее и массы исходной навески - состав
кристаллогидрата.
Оборудование. Весы, горелка, штатив с кольцом и
фарфоровым треугольником, чашка для выпаривания, стеклянная палочка,
ступка фарфоровая с пестиком, эксикатор (желателен).
Реактивы. Кристаллогидрат, содержание воды в котором
предполагается определить (выдает преподаватель).
Ход работы. Закрепляют в штативе кольцо, кладут на него
фарфоровый треугольник. Ставят на весы чашку для выпаривания и
обнуляют тару. В чашку отбирают навеску ~10 г кристаллогидрата и записывают точную массу.
Никаких новых обнулений тары после этого делать нежелательно.
Чашку для выпаривания с веществом ставят на фарфоровый треугольник и
нагревают на газовой горелке (Рис. 4), иногда перемешивая кристаллы
стеклянной палочкой. Если кристаллы плавятся, нагревают их аккуратно,
не допуская бурного кипения с разбрызгиванием. Нагревание прекращают,
когда все кристаллы равномерно изменят цвет. После этого чашку остужают
и взвешивают. Записывают массу. После взвешивания чашку нагревают еще
некоторое время и процедуру взвешивания повторяют. И так до тех пор,
пока массы при двух последовательных взвешиваниях не совпадут.
Обработка результатов. По разности между начальной и
конечной массой находят массу потерянной воды, а из нее, зная массу
исходной навески - состав кристаллогидрата (сколько молекул воды
приходится на одну формульную единицу).
Отчет. В отчете должно быть указание, состав какого
кристаллогидрата необходимо было определить, приведены общие формулы
для расчета. Должны быть указаны исходная навеска кристаллогидрата и
его масса после прокаливания. В выводе дается формула кристаллогидрата
с указанием количества молекул воды в одной формульной единице.
Контрольные вопросы.
Почему нельзя ставить чашку для выпаривания непосредственно на железное
кольцо?
Может ли число молекул воды, приходящееся на одну формульную единицу,
быть не целым?
За счет чего определенное Вами число молекул воды может отличаться от
реальности?
Определение концентрации
веществ колориметрическим методом
с использованием нескольких стандартных растворов (1)
Работа выполняется на РМС «Колориметрия» или УРМС.
Задача. Определить концентрацию раствора по его
оптической плотности, приготовив предварительно калибровочный график.
Теория. Поглощение света определенной длины волны зависит
от концентрации в соответствии с законом Бугера-Ламберта-Бэра:
|
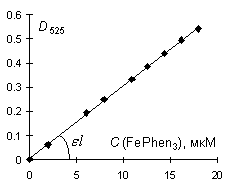
Рис. 5
Зависимость оптической плотности раствора комплексного
соединения железа (II) с фенантролином при 525 нм от
концентрации в кювете L-Micro.
|
lg(I/I0) = eЧCЧl,
где I - интенсивность светового излучения соответствующей длины
волны, прошедшего через поглощающий раствор; I0 -
интенсивность того же света, попавшее на поглощающее вещество; e
- коэффициент экстинкции (молярный коэффициент светопоглощения),
зависящий от природы поглощающего вещества и длины волны света;
С - молярная концентрация поглощающего вещества; l -
длина оптического пути (длина пути, который луч света проходит через
поглощающий раствор). Величина
D = lg(I/I0)
называется оптической плотностью раствора.
Из закона Бугера-Ламберта-Бэра следует, что оптическая плотность прямо
пропорциональна концентрации поглощающего вещества в растворе. Если
построить калибровочный график, то есть взять несколько растворов
известной концентрации и измерить их оптические плотности (D),
то по графику, зная оптическую плотность исследуемого раствора, можно
определить концентрацию. Если даже само вещество, концентрацию которого
требуется определить, не окрашено, можно ввести в раствор
вещество-индикатор, дающее окраску в присутствии определяемого
вещества. Так, чтобы определить концентрацию железа (II) в растворе, в
него вводят фенантролин, дающий с этим ионом ярко-красную окраску.
Иногда в исследуемые растворы также приходится вводить модификаторы
кислотности (например, буферные растворы, создающие значения рН,
оптимальные для образования стабильной и воспроизводимой окраски;
маскирующие агенты, связывающие мешающие вещества). Концентрация этих
веществ, равно как и индикатора, во всех стандартных растворах должна
быть одинаковой.
Для
того, чтобы построить точный калибровочный график, в нескольких мерных
колбах готовят стандартные растворы, содержащие строго определенную
концентрацию исследуемого вещества и одинаковые концентрации остальных
реагентов. Оптическую плотность каждого раствора измеряют. В некоторых
случаях можно использовать менее точный способ - добавлять запасный
раствор исследуемого вещества определенными порциями, рассчитывать
каждый раз концентрацию исследуемого вещества и измерять оптическую
плотность после каждого добавления. Этот способ менее точен, но при
этом и менее трудоемок.
План работы. Подбирают датчик оптической плотности.
Готовят серию стандартных растворов. Измеряют их оптическую плотность.
Строят калибровочный график. Измеряют оптическую плотность в пробе.
Используя калибровочный график, рассчитывают концентрацию вещества в
пробе.
Оборудование. Компьютер с измерительным блоком; линейка
светодиодов; датчик оптической плотности (выбирается из датчиков 400,
475, 525, 595 нм по результатам опыта со светодиодной линейкой);
кювета; 6 мерных колб на 100 мл; градуированные пипетки на 2 и 10 мл.
Реактивы. В мерных колбах на 100 мл готовят серию
стандартных растворов, содержащих концентрации веществ, указанные в
Табл. 1. Их готовят, добавляя в мерную колбу соответствующий объем
запасных реактивов для фона (Табл. 1) и рассчитанный объем запасного
раствора определяемого реактива (этот объем студентам предполагается
рассчитать самостоятельно). Возможны другие реактивы.
Табл. 1
Возможные вещества для определения фотометрическим методом в работе 2.3
и условия определения
|
Определяемое вещество
|
Концентрации в серии
|
Запасной р-р
|
Фон
|
Запасные растворы для фона
|
Их объем, мл
|
|
Cu2+
|
0; 2; 4; 6; 8; 10 мМ
|
CuSO4 0.1 M на H2SO4 0.01M
|
NH3 1 M
|
NH3 5 M
|
20
|
|
Ni2+
|
0; 0.01; 0,02; 0.03; 0.04; 0.05 М
|
то же
|
NH3 1M
|
NH3 5 M
|
20
|
|
Fe общее
|
0; 2; 5; 10; 15; 20; 25 мкМ
|
FeCl3 0.01М
на HCl 0.1M
|
0.01М фенантролин
0.01M гидроксиламиновый буфер
|
фенантролин 0.1 М; гидроксиламиновый буфер рН 6 0.01 М
|
10
10
|
|
I2/KI
|
0; 1; 2; 3; 4; 5 мМ
|
0.01 М I2 на 0.1М KI
|
0.01М KI
|
1М KI
|
1
|
|
KMnO4
|
0; 20; 40; 60; 80; 100 мкМ
|
KMnO4 1 мМ
|
вода
|
-
|
-
|
|
Метилоранж
|
0; 0.5; 1; 1.5; 2; 2.5 мг/л
|
Метилоранж
50 мг/л
|
Na2B4O7 0.01M
|
Na2B4O7 0.1M
|
10
|
|
Метилоранж
|
0; 0.5; 1; 1.5; 2; 2.5 мг/л
|
Метилоранж
50 мг/л
|
KH3(C2O4)2 0.01M
|
KH3(C2O4)2 0.1M
|
10
|
Кроме того, студент получает раствор с неизвестной концентрацией того
же реактива (пробу), приготовленный преподавателем.
Подбор датчика оптической плотности. В сухую кювету
наливают раствор с самой большой концентрацией. Подключают светодиодную
линейку к третьему разъему измерительного блока. Смотрят на линейку с
горящими диодами через кювету с раствором и определяют, свет с какой
длиной волны проходит через него хуже всего. Выбирают датчик именно с
этой длиной волны. Раствор из кюветы выливают обратно в мерную колбу и
кювету ополаскивают.
Подготовка измерительной системы. Подключают датчик
оптической плотности к первому разъему компьютерного измерительного
блока. В меню программы L-Химия - практикум (РМС «Колориметрия)
выбирают пункт «Зависимость оптической плотности от концентрации: одна
длина волны». Сценарий работает в режиме ручного ввода абсциссы.
Выходят в окно запуска эксперимента.
Ход работы. Заливают в кювету фоновый раствор (с нулевой
концентрацией определяемого вещества) и настраивают по нему датчик
(см. описание датчика, С. 20).
После настройки переходят в окно записи эксперимента. Не снимая кювету,
запускают процесс измерения нажатием экранной кнопки «Пуск». После чего
нажимают кнопку «Выбор»и в появившееся окно записи вводят значение
концентрации (в данном случае - 0). Нажатием на клавишу «Enter» или
экранной кнопки «Запись» вводят в компьютер значение оптической
плотности при этой концентрации. Снимают датчик с кюветы, сливают из
нее раствор, ополаскивают кювету небольшим объемом второго раствора (с
наименьшей концентрацией определяемого вещества) и заливают в нее
второй раствор. Повторяют процедуру ввода оптической плотности при
данной концентрации. И так далее - до раствора с самой большой
концентрацией. Останавливают измерение нажатием экранной кнопки «Стоп»
и сохраняют результаты нажатием экранной кнопки «Архив». После чего
кювету ополаскивают сначала дистиллированной водой, потом - небольшой
порцией пробы. Заливают пробу в кювету и измеряют ее оптическую
плотность. Результат записывают или вводят в соответствующую графу
отчета в программе Excel.
Обработка результатов. Открывают файл с полученными
результатами. В нем первый столбец - концентрации, второй - оптические
плотности при этих концентрациях. Строят график зависимости
концентрации от оптической плотности и аппроксимируют его прямой линией
(графически и аналитически). Если какая-то из точек явно выпадает
графика, ее отбрасывают, либо еще раз готовят соответствующий раствор и
перемеряют его оптическую плотность. Получившаяся прямая и будет
калибровочным графиком.
Определить концентрацию реагента в пробе можно двумя способами:
графическим и аналитическим.
При
определении графическим способом проводят прямую, параллельную оси
абсцисс и начинающуюся в точке с оптической плотностью пробы до ее
пересечения с калибровочным графиком. От пересечения проводят прямую
вниз перпендикулярно оси абсцисс до пересечения с ней. Точка
пересечения соответствует концентрации вещества в пробе.
При
аналитическом определении аппроксимируют калибровочный график прямой
вида
D = aЧC + b.
При этом определяются a и b. Подставляют в полученное
уравнение величину D в пробе и решают его относительно C:
С = (D-b)/a
Отчет. В отчете следует указать, концентрацию какого
вещества определяли и какую длину волны для этого выбрали. Нужно также
привести расчеты объемов запасных растворов для приготовления
стандартных (в форме таблицы). В результатах следует дать калибровочный
график и привести уравнение калибровочной прямой. Также следует
отметить оптическую плотность пробы. В выводе указать концентрацию
вещества в пробе.
Контрольные вопросы.
Почему при подборе датчика оптической плотности кювета должна быть
сухой?
Можно ли строить калибровочный график, измеряя оптическую плотность
растворов от большей концентрации к меньшей?
Почему при смене растворов во время построения калибровочного графика
кювету не ополаскивают дистиллированной водой, а после - ополаскивают?
Определение концентрации веществ колориметрическим
методом с использованием одного стандартного раствора (2)
Работа выполняется на РМС «Колориметрия» или УРМС.
Задача. Определить концентрацию раствора по его
оптической плотности, приготовив предварительно калибровочный график. В
отличие от предыдущей работы, калибровочный график строится с
использованием одного стандартного раствора.
Теория. См. предыдущую работу. Данная работа отличается
способом построения калибровочного графика. Вместо того, чтобы готовить
серию из нескольких растворов, берут один фоновый раствор и порциями
добавляют к нему определяемый реагент. Поскольку растворы разбавленные,
их объемы можно считать аддитивными, поэтому концентрацию определяемого
реагента в растворе можно в любой момент рассчитать.
Оборудование. Компьютер с измерительным блоком; линейка
светодиодов; датчик оптической плотности (выбирается из датчиков 400,
475, 525, 595 нм по результатам опыта со светодиодной линейкой);
кювета; градуированные пипетки на 2 и 10 мл; мерный цилиндр на 100 мл;
шприц на 10 мл.
Реактивы. Используют два раствора. Первый раствор
предназначен для заливания в кювету (фон). Фон содержит
дистиллированную воду, иногда - индикатор, модификатор кислотности
(чтобы подавить гидролиз или обеспечить более полное взаимодействие
определяемого вещества с индикатором), другие модификаторы среды.
Второй раствор - запасный раствор определяемого вещества в определенной
концентрации.
Табл. 2
Возможные вещества для определения фотометрическим методом в работе
2.4. и условия определения
|
Реактив
|
Индикатор
|
Фоновый раствор
|
Запасный раствор
|
|
Cu2+
|
-
|
H2SO4 0.1M
|
CuSO4 0.5 M
|
|
Cu2+
|
NH3
|
NH3 1M
|
CuSO4 0.1 M
|
|
Ni2+
|
-
|
H2SO4 0.1M
|
NiSO4 0.5 M
|
|
Ni2+
|
NH3
|
NH3 1M
|
NiSO4 0.2 M
|
|
Fe общее
|
Фенантролин
|
Фенантролин 0.01М; гидроксиламиновый буфер рН 6 0.01М
|
FeCl3 2Ч10-4 M на 0.01М фенантролине +
0.01М гидроксиламиновом буфере.
|
|
I2/KI
|
-
|
KI 0.1M
|
0.01 М на 0.1М KI
|
|
KMnO4
|
-
|
H2SO4 0.01M
|
KMnO4 1 мМ
|
|
Метилоранж
|
-
|
Na2B4O7 0.01M
|
Метилоранж 50 мг/л
|
|
Метилоранж
|
-
|
KH3(C2O4)2 0.01M
|
Метилоранж 50 мг/л
|
Кроме того, студент получает раствор с неизвестной концентрацией того
же реактива (пробу), приготовленный преподавателем.
План работы. Подбирают датчик оптической плотности. В
фоновый раствор добавляют запасный раствор определяемого вещества и
после каждого добавления замеряют его оптическую плотность. Строят
калибровочный график. Измеряют оптическую плотность в пробе. Используя
калибровочный график, рассчитывают концентрацию вещества в пробе.
Подготовка измерительной системы. Датчик оптической
плотности подключают к первому разъему компьютерного измерительного
блока. В меню программы L-Химия - практикум из раздела
«Титрование» выбирают пункт «Титрование с одним датчиком: Титрование с
контролем оптической плотности: ручной ввод шага». Выходят в окно
запуска эксперимента. Сценарий работает в режиме ручного ввода шага.
Подбор датчика оптической плотности. В кювету наливают
запасный раствор, раствор с самой большой концентрацией. Подключают
светодиодную линейку к третьему разъему измерительного блока. Смотрят
на линейку с горящими диодами через кювету с раствором и определяют,
свет с какой длиной волны проходит через него хуже всего. Выбирают
датчик именно с этой длиной волны. Раствор из кюветы выливают обратно в
мерную колбу и кювету ополаскивают.
Ход работы. Ставят кювету на магнитную мешалку, помещают
в нее якорь и надевают датчик оптической плотности. Запускают процесс
перемешивания. В кювету мерным цилиндром отбирают 100 мл фонового
раствора. По нему, нажав экранную кнопку «Настройка оборудования»
настраивают датчик (см. описание датчика на С. 20). Переходят в окно
измерений. Нажатием на экранную кнопку «Пуск» запускают процесс
измерения. Нажимают на кнопку «Выбор» и в появившемся окне изменяют
либо подтверждают предложенное значение шага, через который
будет добавляться реагент. Далее добавляют в раствор из шприца
определенный объем запасного раствора определяемого реагента. Начинают
добавлять с объема, соответствующего наименьшей цене деления шприца.
Если с каждой порцией оптическая плотность увеличивается меньше, чем на
0.05, объем порции увеличивают. После добавления каждой порции
нажимают на экранную кнопку «Выбор»и подтверждают либо изменяют объем
шага. Так до тех пор, пока не кончится запасный раствор определяемого
реагента или оптическая плотность не достигнет значения 1 или другого
заданного преподавателем. Останавливают измерение нажатием экранной
кнопки «Стоп» и сохраняют результаты нажатием экранной кнопки «Архив».
После этого кювету ополаскивают раствором фоновых реактивов и небольшим
количеством пробы. Заливают пробу в кювету и измеряют его оптическую
плотность. Результат записывают или вводят в соответствующую графу
файла отчета в программе «Excel».
Обработка результатов. Открывают полученный файл в
программе «Excel». В нем первый столбец - объем раствора определяемого
реагента, второй - оптические плотности при этих объемах. Объем
реагента нужно пересчитать в концентрацию. Для этого перед имеющимся
массивом данных вставляют две строки. В первую ячейку первой строки
вводят значение концентрации определяемого реагента в запасном
растворе, второй строки - объем фонового раствора. После чего между
первым и вторым столбцом вставляют еще два. Получают пустые столбцы
второй и третий (B и C). В столбце B рассчитывают суммарный объем
раствора, складывая исходный объем фонового раствора и объем
добавленного раствора определяемого реагента. В столбце C рассчитывают
концентрацию реагента в полученном растворе, умножая концентрацию
реагента в запасном растворе на объем добавленного запасного раствора и
деля полученное значение на суммарный объем раствора.
Строят график зависимости концентрации от оптической плотности и
аппроксимируют его прямой линией (графически и аналитически). Если
какая-то из точек явно выпадает графика, ее отбрасывают. Получившаяся
прямая и будет калибровочным графиком.
Определить концентрацию реагента в пробе можно двумя способами:
графическим и аналитическим.
При
определении графическим способом проводят прямую, параллельную оси
абсцисс и начинающуюся в точке с оптической плотностью пробы до ее
пересечения с калибровочным графиком. От пересечения проводят прямую
вниз перпендикулярно оси абсцисс до пересечения с ней. Точка
пересечения соответствует концентрации вещества в пробе.
При
аналитическом определении аппроксимируют калибровочный график прямой
вида
D = aЧC + b.
При этом определяются a и b. Подставляют в полученное
уравнение величину D в пробе и решают его относительно C:
С = (D-b)/a
Отчет. В отчете следует указать, концентрацию какого
вещества определяли и какую длину волны для этого выбрали. Нужно также
привести расчеты объемов запасных растворов для приготовления фона. В
результатах следует дать калибровочный график и привести уравнение
калибровочной прямой. Также следует отметить оптическую плотность
пробы. В выводе указать концентрацию вещества в пробе.
Возможные вариации. Данную задачу можно решать, используя
два датчика оптической плотности. В этом случае датчики оптической
плотности подключаются к разъемам №1 и №2 и используется сценарий
«Титрование с двумя датчиками: Титрование с контролем оптической
плотности: ручной ввод шага». Соответственно, получится два
калибровочных графика.
Определение концентрации веществ кондуктометрическим
методом
с использованием нескольких стандартных растворов (1)
|
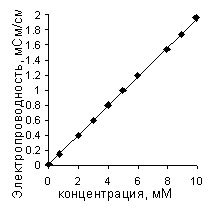
Рис. 6. Пример калибровочного
графика для определения концентрации сильного электролита по
электропроводности раствора
|
Работа выполняется на РМС «Кондуктометрия», «Перегонка» или УРМС.
Задача. Построить калибровочный график для определения
концентрации сильного электролита по электропроводности его раствора и
определить концентрацию электролита в неизвестном растворе.
Теория. Электропроводность растворов сильных электролитов
зависит от их концентрации. До концентрации ~0.01М эта зависимость
линейна. Если построить калибровочный график (Рис. 6), то есть взять
несколько растворов известной концентрации и измерить их
электропроводность, то по нему, зная электропроводность исследуемого
раствора, можно определить концентрацию электролита в нем.
Оборудование. Компьютер с измерительным блоком; датчик
электропроводности; химический стаканчик на 50 мл; градуированная
мерная пипетка на 2 мл, мерные колбы на 50 мл.
Реактивы. Раствор любого сильного электролита с
концентрацией 0.1М; раствор того же электролита неизвестной
концентрации (до 5мМ).
План работы. Готовят серию растворов с концентрациями 0,
1, 2, 3, 4, 5 мМ. Измеряют электропроводность в каждом из них. Строят
калибровочный график. Измеряют электропроводность в пробе. Используя
калибровочный график, рассчитывают концентрацию вещества в пробе.
Подготовка измерительной системы. Датчик
электропроводности подключают к первому разъему компьютерного
измерительного блока. Переключают датчик на диапазон 0-1 мСм/см. В меню
программы L-Химия - практикум выбирают пункт
«РМС «Кондуктометрия»: Определение концентрации кондуктометрическим
методом: диапазон 0-1 мСм/см». Сценарий работает в режиме ручного ввода
абсциссы.
Ход работы. В четыре мерных колбы на 50 мл отбирают,
соответственно, 0.5, 1, 1.5, 2 и 2.5 мл запасного раствора электролита
0.1 М. В каждой колбе объем раствора доводят водой до метки. Затыкают
каждую колбу пробкой и перемешивают ее содержимое, опрокидывая не менее
15 раз. В стаканчик наливают дистиллированную воду и погружают щуп
датчика электропроводности. Нажатием на экранную кнопку «Пуск»
запускают процесс измерения и нажатием на экранную кнопку
«Выбор»вызывают окно ввода абсциссы. В него вводят значение
концентрации (в данном случае - 0) и нажимают клавишу «Enter».
Стаканчик и щуп ополаскивают небольшим количеством первого раствора.
После этого наливают первый раствор в стакан и погружают щуп датчика
электропроводности в него. Процедуру ввода значения концентрации и
электропроводности при этой концентрации повторяют. И так для всех
остальных растворов. Останавливают измерение нажатием экранной кнопки
«Стоп» и сохраняют результаты нажатием экранной кнопки «Архив».
Стаканчик и щуп промывают дистиллированной водой.
Когда преподаватель выдаст раствор неизвестной концентрации, небольшим
его объемом ополаскивают щуп и стаканчик. После чего наливают
неизвестный раствор в стаканчик, погружают в щуп и считывают значение
электропроводности в соответствующем окне на экране. Значение
записывают.
Обработка результатов. Открывают файл с полученными
результатами. В нем первый столбец - концентрации, второй -
электропроводность при этих концентрациях. Строят график зависимости
концентрации от электропроводности и аппроксимируют его прямой линией
(графически и аналитически). Если какая-то из точек явно выпадает
графика, ее отбрасывают, либо еще раз готовят соответствующий раствор и
перемеряют его электропроводность. Получившаяся прямая и будет
калибровочным графиком.
Определить концентрацию реагента в пробе можно двумя способами:
графическим и аналитическим.
При
определении графическим способом проводят прямую, параллельную оси
абсцисс и начинающуюся в точке с электропроводностью пробы до ее
пересечения с калибровочным графиком. От пересечения проводят прямую
вниз перпендикулярно оси абсцисс до пересечения с ней. Точка
пересечения соответствует концентрации вещества в пробе.
При
аналитическом определении аппроксимируют калибровочный график прямой
вида
k= aЧС + b.
При этом определяются a и b. Подставляют в полученное
уравнение величину k в пробе и решают его относительно C:
С = (k-b)/a
Отчет. В отчете следует указать, концентрацию какого
вещества определяли. В результатах следует дать калибровочный график и
привести уравнение калибровочной прямой. Также следует отметить
электропроводность пробы. В выводе указать концентрацию вещества в
пробе.
Контрольные вопросы.
Можно ли строить калибровочный график, измеряя электропроводность от
большей концентрации к меньшей?
Зачем при каждом измерении ополаскивать щуп и стаканчик исследуемым
раствором?
Почему нельзя ополаскивать их дистиллированной водой?
Можно ли этим методом определить концентрацию раствора 0.02М и какие
изменения нужно внести в ход работы?
Можно ли этим методом определить концентрацию NaCl в отсутствии других
растворенных веществ?
При каких условиях можно определить этим методом концентрацию NaCl в
растворе, в котором растворены и другие соли?
Определение концентрации
веществ кондуктометрическим методом
с использованием одного стандартного раствора (2)
Работа выполняется на РМС «Кондуктометрия» или УРМС.
Задача. Построить градуировочный график для определения
концентрации сильного электролита по электропроводности его раствора и
определить концентрацию электролита в пробе. В отличие от предыдущей
задачи, калибровочный график будет строиться с использованием одного
раствора.
Теория. См. теорию к работе 2.5. В данной работе серию
растворов разной концентрации вы будете получать, добавляя запасный
раствор в дистиллированную воду и измеряя оптическую плотность после
каждого добавления.
Оборудование. Компьютер с измерительным блоком; датчик
электропроводности; датчик объема жидкого реагента со шприцом на 10
мл; химический стакан на 100 мл; химический штатив.
Реактивы. Запасной раствор любого сильного электролита с
концентрацией 0.1М; раствор того же электролита неизвестной
концентрации (до 5мМ).
План работы. В дистиллированную воду добавляют запасный
раствор определяемого вещества и после каждого добавления замеряют
его электропроводность. Строят калибровочный график. Измеряют
электропроводность в пробе. Используя калибровочный график,
рассчитывают концентрацию вещества в пробе.
|
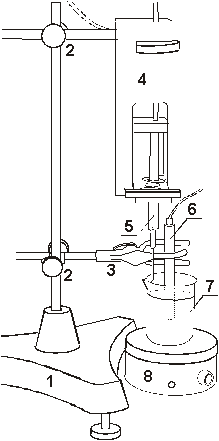
Рис. 7.
Установка для кондуктометрического титрования с датчиком
объема жидкого реагента. 1 -
штатив, 2- муфты, 3 - лапка, 4 - датчик объема жидкого
реагента, 5 - шприц, 6 - датчик электропроводности,
7 - стакан химический, 8 - магнитная мешалка.
|
Подготовка измерительной системы к работе. Закрепляют в
штативе датчик объема жидкого реагента и датчик электропроводности.
Переключают датчик электропроводности на диапазон 0-1 мСм/см.
Подключают датчик электропроводности к первому разъему компьютерного
измерительного блока, датчик объема жидкого реагента - ко второму. В
меню программы L-Химия - практикум выбирают пункт «Титрование:
Титрование с одним датчиком: Кондуктометрическое титрование
(диапазон 0-1 мСм/см): Автоматическое определение объема титранта».
Сценарий работает в режиме записи отдельных точек. Выходят в окно
запуска эксперимента. В нем нажимают кнопку «Настройка оборудования»
и в появившемся окне вводят объем, указанный на шкале шприца и ее
длину. После чего переходят в окно измерений.
Ход работы. Ставят на магнитную мешалку химический
стакан. Мерной колбой или цилиндром на 100 мл наливают в него 10 мл
дистиллированной воды. Погружают в него датчик электропроводности,
заполняют шприц запасным раствором электролита и снаряжают им датчик
объема жидкого реагента (см. описание на С. 45). Когда датчик объема
жидкого реагента готов к работе и толкатель уперся в поршень, запускают
измерение нажатием на экранную кнопку «Пуск». После чего нажатием
экранной кнопки «Выбор» вводят в компьютер значение электропроводности
до добавления раствора. Далее добавляют 0.5 мл раствора электролита и
нажатием экранной кнопки «Выбор» фиксируют значение электропроводности
при этом объеме. И так пока не выйдет 6 мл раствора электролита.
Останавливают измерение нажатием экранной кнопки «Стоп» и сохраняют
результаты нажатием экранной кнопки «Архив».
После построения калибровочного графика щуп и стаканчик ополаскивают
небольшим объемом пробы, наливают в него пробу, замеряют ее
электропроводность. Записывают значение электропроводности или вводят
ее в соответствующую графу файла отчета.
Обработка результатов. Открывают файл с полученными
результатами. В нем первый столбец (А) - объем электролита, второй (В)
- электропроводность при этих объемах. Для построения калибровочного
графика нужно пересчитать объем добавленного электролита в его
концентрацию в получившемся растворе. Для этого после столбца объемов
нужно добавить еще два столбца. В одном из них рассчитывают объем
раствора как сумму исходного объема и объема добавленного электролита
(объемы считать аддитивными). В другом - концентрацию электролита по
формуле С =
С0ЧVe/Vр-ра , где
С0 - концентрация электролита в запасном растворе,
Ve - его объем, Vр-ра - объем
полученного раствора.
Строят график зависимости концентрации электролита от
электропроводности и аппроксимируют его прямой линией (графически и
аналитически). Если какая-то из точек явно выпадает графика, ее
отбрасывают, либо еще раз готовят соответствующий раствор и перемеряют
его электропроводность. Получившаяся прямая и будет калибровочным
графиком.
Определить концентрацию реагента в пробе можно двумя способами:
графическим и аналитическим.
При
определении графическим способом проводят прямую, параллельную оси
абсцисс и начинающуюся в точке с электропроводностью пробы до ее
пересечения с калибровочным графиком. От пересечения проводят прямую
вниз перпендикулярно оси абсцисс до пересечения с ней. Точка
пересечения соответствует концентрации вещества в пробе.
При
аналитическом определении аппроксимируют калибровочный график прямой
вида
k= aЧС + b.
При этом определяются a и b. Подставляют в полученное
уравнение величину k в пробе и решают его относительно C:
С = (k-b)/a
Отчет. В отчете следует указать, концентрацию какого
вещества определяли. В результатах следует дать калибровочный график и
привести уравнение калибровочной прямой. Также следует отметить
электропроводность пробы. В выводе указать концентрацию вещества в
пробе.
Возможные вариации. Более корректно проводить этот опыт с
термостатированием, поскольку электропроводность раствора зависит от
температуры. Для этого потребуется внутренний термостат и кювета вместо
химического стакана и бюретка вместо датчика объема жидкого реагента.
Термостат подключают к разъемам №2 и №3. Также следует использовать
программный сценарий «РМС «Кондуктометрия»: Кондуктометрическое
титрование с термостатированием».
Контрольные вопросы.
Какие погрешности возникают при отборе 100 мл воды при помощи мерной
колбы?
Какой программный сценарий следует использовать, если вместо датчика
объема жидкого реагента брать бюретку?
Почему, хотя предполагается определять концентрацию электролита до 5мМ,
при построении калибровочного графика добавляют 6 мл запасного
раствора?
Определение температуры плавления кристаллогидратов и
изучение пересыщенных растворов (2)
Работа выполняется на РМС «Кондуктометрия» или УРМС.
Задача.Определить температуру плавления кристаллогидрата;
получить и закристаллизовать пересыщенный раствор и определить
изменение температуры при кристаллизации.
Теория. В состав кристаллов многих ионных соединений
(кислот, оснований, солей) входит вода, молекулы которой упорядоченно
расположены в кристаллической решетке. Такие кристаллы называются
кристаллогидратами. Молекулы воды в кристаллогидрате как правило,
окружают ионы (чаще всего катионы). Можно сказать, что при образовании
кристаллогидратов из водных растворов ионы встраиваются в
кристаллическую решетку вместе со своей гидратной оболочной. При
нагревании гидратная оболочка ионов разрушается и вода высвобождается.
Если это происходит при температуре ниже температуры кипения воды, а
растворимость ионного соединения достаточно велика, оно растворяется в
выделившейся кристаллизационной воде. Такой процесс называется
плавлением кристаллогидрата. В процессе плавления температура не
изменяется. Также не изменяется она в процессе обратной кристаллизации.
Если кристаллогидрат расплавили в чистой пробирке, он может при
охлаждении образовать пересыщенный раствор, то есть остаться в жидком
состоянии при температуре ниже температуры плавления. Если внести в
такой раствор затравку, например, твердый кристалл вещества,
кристаллогидрат довольно резко закристаллизуется, причем температура
его изменится.
|
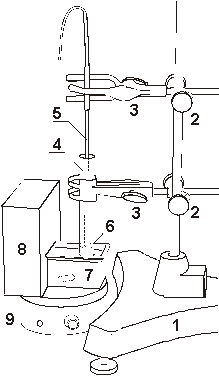
Рис. 8. Установка для определения
температуры плавления кристаллогидрата с использованием
термостата. 1 - штатив, 2 - муфты, 3 - лапки,
4 - пробирка, 5 - датчик температуры, 6 -
кристаллогидрат, 7 - кювета, 8 - термостат, 9 -
магнитная мешалка.
|
План работы. Нагревают кристаллогидрат на водяной бане и
записывают зависимость температуры от времени. Когда оно полностью
расплавится, баню извлекают и оставляют его охлаждаться, продолжая
записывать зависимость температуры от времени. Если при охлаждении
кристаллогидрата до комнатной температуры он не закристаллизуется,
бросают в расплав два-три кристаллика кристаллогидрата и продолжают
записывать зависимость температуры от времени.
Оборудование. Компьютер с измерительным блоком,
термостатирующее устройство с блоком питания, датчик температуры
0-100°С, кювета, магнитная мешалка, пробирка, шприц на 10 мл.
Реактивы. Кристаллогидрат, плавление которого требуется
изучить. В качестве такого кристаллогидрата подойдут
CaCl2Ч6H2O,
Na2S2O3Ч5H2O,
Na2SO4Ч10H2O.
Подготовка измерительной системы. К первому разъему
измерительного блока подключают датчик температуры, к управляющему
разъему - термостатирующее устройство. Последнее подключают также к
блоку питания. Насыпают в пробирку кристаллогидрат на 4-5 см по высоте.
Собирают установку (Рис. 8). Датчик температуры должен быть погружен в
кристаллогидрат почти до дна пробирки, но не касаться ее стенок. В меню
программы L-Химия - практикум, выбирают пункт «РМС
«Кондуктометрия»: Определение температуры плавления легкоплавкого
вещества». Выходят в окно запуска эксперимента. Нажимают экранную
кнопку «Настройка оборудования» и выставляют диапазон температур в
термостате 30-70°С.
Ход работы. Нажатием на экранную кнопку «Пуск» запускают
нагревание и измерение температуры (термостат может включиться не
сразу). Наблюдают изменение температуры в процессе плавления
кристаллогидрата. Когда кристаллогидрат полностью расплавится,
отключают термостат нажатием кнопки выключения на блоке питания.
Снимают термостат с кюветы, выдвигают из-под нее магнитную мешалку,
убирают кювету с водой, оставив расплав остывать на воздухе. Когда
температура упадет до 22-30°С, если вещество не закристаллизовалось, в
пробирку вносят кристаллик кристаллогидрата. Наблюдают кристаллизацию
вещества и следят за ходом температуры. Когда температура начнет снова
падать, останавливают процесс измерений нажатием на экранную кнопку
«Стоп» и сохраняют результаты нажатием экранной кнопки «Архив».
Эксперимент желательно повторить, не меняя содержимое пробирки. Кроме
того, весьма вероятно, что для извлечения датчика температуры,
кристаллогидрат снова придется расплавить.
Обработка результатов. Открывают полученный файл. В нем первый столбец
- время, второй - температура в пробирке с кристаллогидратом, третий -
температура в среде, в которую погружено термостатирующее устройство.
Строят зависимость температуры в пробирке с кристаллогидратом от
времени. Плато на ней соответствует температуре плавления (застывания)
кристаллогидрата. Сравнивают их.
Отчет. В отчете должна быть приведена кривая зависимости
температуры от времени эксперимента с указанием основных этапов
(нагревание, плавление, охлаждение, кристаллизация). Также должна быть
указана температура плавления кристаллогидрата.
Контрольные вопросы.
Какой знак имеет тепловой эффект процесса плавления кристаллогидрата?
Его кристаллизации из насыщенного раствора?
В каком случае тепловой эффект растворения больше: если растворяется
безводная соль или соответствующий кристаллогидрат?
Зачем пробирка должна быть чистой?
Если в
кристаллогидрате присутствуют комки, их необходимо измельчить в
ступке.
Как и в предыдущей
работе, методики приготовления и стандартизации растворов опущены.
|  Поиск по сайту
Поиск по сайту  Карта сайта
Карта сайта  English
English  Поиск по сайту
Поиск по сайту  Карта сайта
Карта сайта  English
English